化学家会给很多现象编解释,到底对不对另说,先把学生唬住。铜银金的特殊性也有解释,不过可能因为涉及相对论,所以基础教程里谈的很少(另一个涉及相对论的6s惰性电子对效应可以有不涉及相对论的解释)。[3]总之下面的解释看看就好,它不一定是唯一的解释也不一定是完全正确的。防杠补丁打完……相关解释叫做The Gold Maximum of Relativistic Effects。(一些中文综述里也没有这个词的翻译,不知道有没有什么信雅达的说法,“相对论效应金最大”感觉比较奇怪)
最近支付宝扫码可以领取红包,运气好的话可以免费领顿早点。
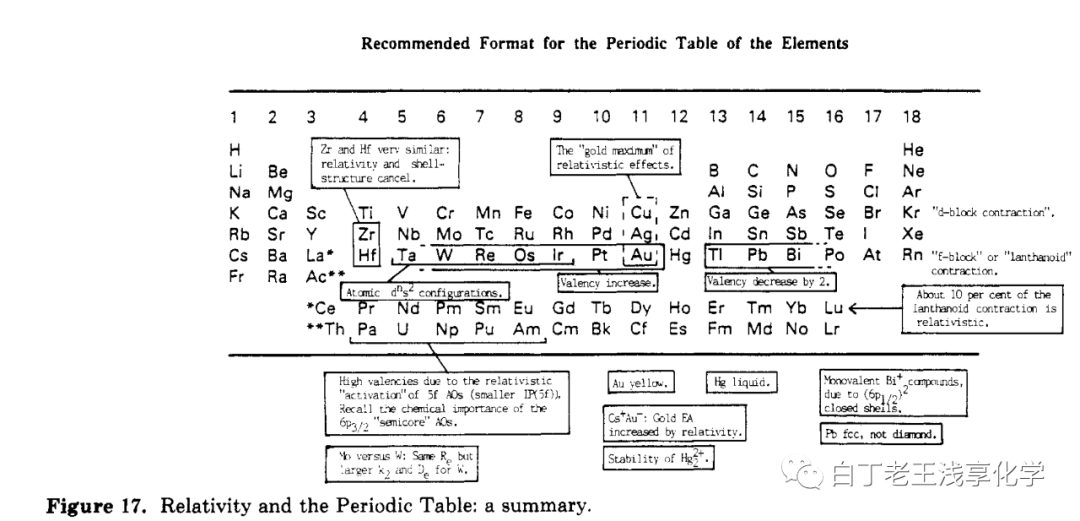
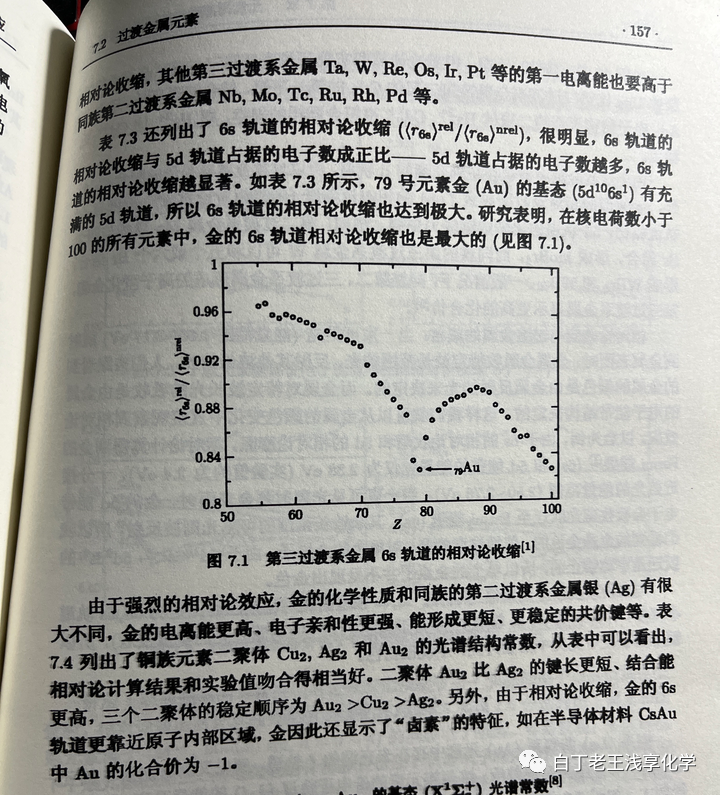
上图来自Chem. Rev. 1988, 88, 3, 563–594[4],图中总结了相对论效应对元素性质的影响。这个效应首先在对金元素相对论效应的研究中发现,利用量子化学方法可以计算考虑相对论效应的6s轨道平均半径
做比值后发现Pt、Au和Hg受相对论效应影响异常大,其中金最大。
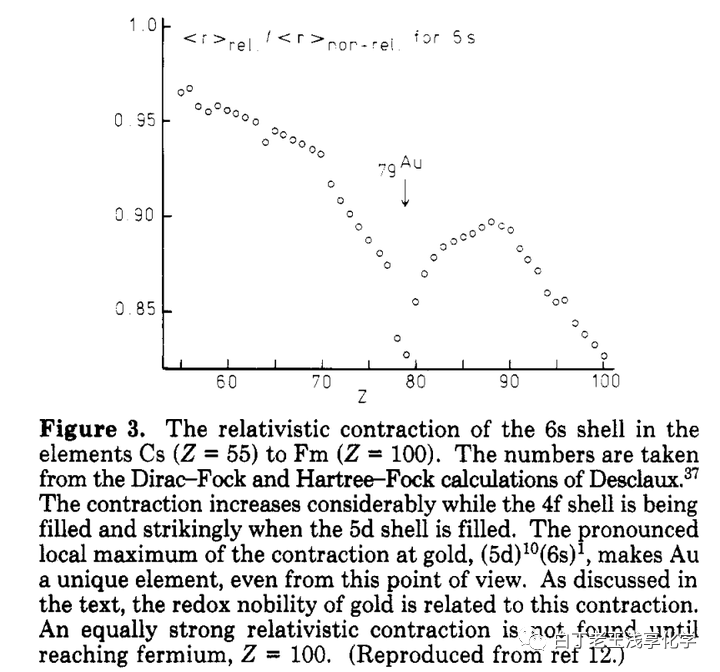
上面这个图可能有误导性,第六周期是55号元素铯→86号元素氡,后面是第七周期了。再后来发现铜和银有类似的现象,意味着和同一周期的附近的元素相比,铜银金受相对论效应更明显,在化学上表现出反应惰性。为了推广这个解释自然也要有一个配套的“基础解释”,以便有朝一日出现在基础化学教材中,也就是说要编一个不用太多的量子力学知识的定性解释,这个也有,比如:[5]因为它们正处在d轨道全充满电子的边缘上,受到直接和间接的相对论效应的作用最大。(注:直接相对论效应是指电子由于自身相对论效应所导致的收缩和自旋-轨道分裂;间接相对论效应是指内层s、p轨道相对论收缩,屏蔽核电荷的能力增强,导致外层d、f轨道的膨胀,即相对论膨胀。)更详细的解释是:s电子受相对论效应的影响大(参考6s惰性电子对效应中原子轨道正交性相关的解释,即1s收缩会引起ns收缩,但pdf电子不受s轨道正交性的限制,)从IA族(group 1)到IIB族(group 11)最外层基本都是ns¹或ns²,对于它们而言,Z越大,电子运动的平均速率v越大,由于相对论效应,电子的质量更大,波尔半径更小。另一点是IIB族之后np轨道上有电子,效应被削弱。不同的电子组态受相对论效应的影响不同, (n−1)dg−1ns1(n-1)d^{g-1}ns^1(n-1)d^{g-1}ns^1 比 (n−1)dg−2ns2(n-1)d^{g-2}ns^2(n-1)d^{g-2}ns^2 更明显。
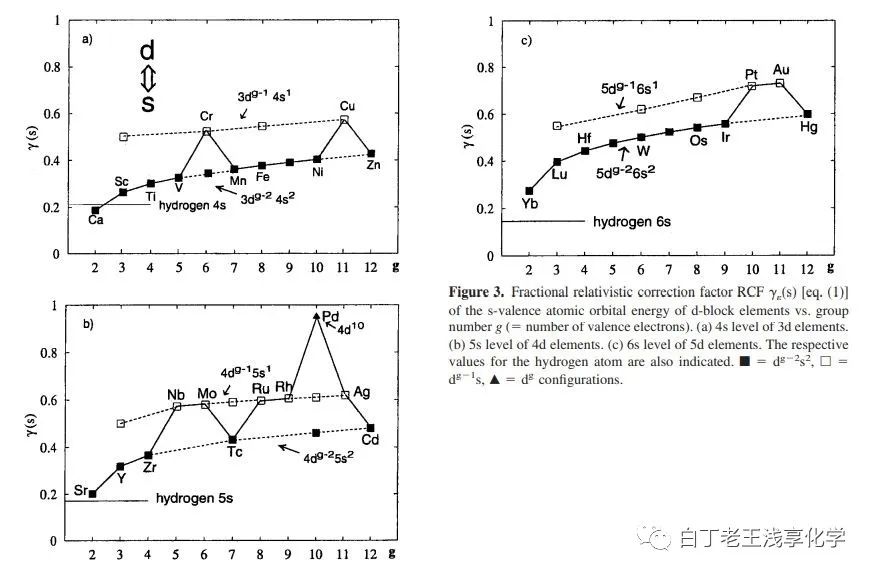
图片来自Dependence of Relativistic Effects on Electronic Configuration in the Neutral Atoms of d- and f-Block Elements . DOI:10.1002/jcc.10060[6]更多细节可以参考相关综述:

来自Relativistic Effects in Chemistry: More Common Than You Thought,Annual Review of Physical ChemistryVol. 63:45-64 (Volume publication date May 2012)[7]这篇综述很明显是希望化学教材多讲些相对论的。

来自引文1(这段话里有这个现象的另一种表述:“……the valence-shell relativistic stabilization and contraction show a pronounced local maximum at the coinage metals Cu, Ag, and Au”,大意是铜族元素价层相对论稳定性/收缩局部最大。)中文资料中的介绍:
曹晓燕等,现代化学基础丛书33《相对论量子化学基础》“这个理论不一定是唯一的解释也不一定是完全正确的”是因为有另一个事实,相对论效应影响金>>银>>铜,铜的相对论效应几乎可以忽略。一般估计原子的相对论效应用下面的公式,原子单位下1s电子的平均速度<vr>约等于原子序数Z,光速≈137.

所以相对论效应导致的质量增加:γ=mm0=11−(Z/137)2gamma=frac{m}{m_0}=frac{1}{sqrt{1-(Z/137)^2}}gamma=frac{m}{m_0}=frac{1}{sqrt{1-(Z/137)^2}} Z:铜29,银47,金79,代进去得到:铜:1.047银:1.133金:1.498所以一般不讨论相对论效应对铜和银的影响,这也是说Gold Maximum的原因。我觉得题主的问题和相对论效应有关是受下面这图的影响。
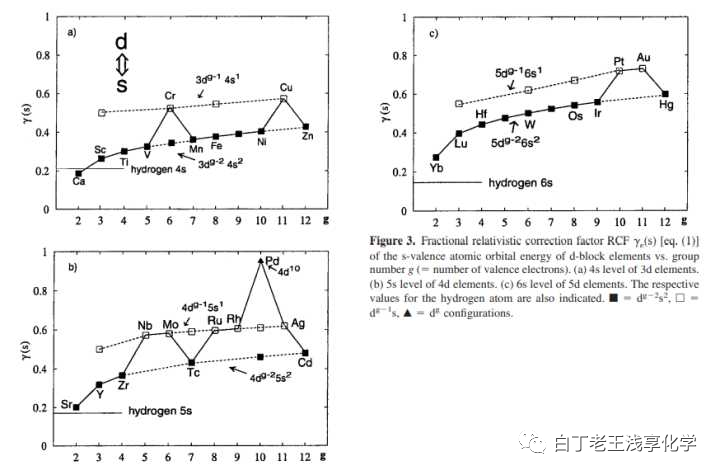
所以前面讲的也是Cu, Ag, Au 等金属受相对论效应的影响局部最大。要否定这个理论应该证明的是铜和锌受相对论效应影响的差异极小。这个理论争议的点是百分之几的影响是否应该被考虑。接受银有相对论效应带来的稳定性的人更多。顺带一提,“金属的电离能越小越活泼”这个似乎理所当然的结论对于铜族和锌族元素是不成立的,银的第一电离能小于铜,镉的也小于锌。这便是基础教材介绍类似结论时总强调讨论范围是主族金属的原因。

https://chem.libretexts.org/Courses/University_of_California_Davis/UCD_Chem_002A/UCD_Chem_2A/Text/Unit_IV%3A_Electronic_Structure_and_Bonding/08%3A_The_Periodic_Table/8.4%3A_Ionization_Energy上面这一点是这个问题的一种解释——“铜银金的金属键更强”的一个依据,评论里有人提到了。讲到金属键强的问题,金元素受相对论效应影响,金属键强是共识,前面中文资料里有具体论述。不过那书上的说法有些激进,类比论的完整论述是:“和碱金属碱土金属不同,受内层d轨道的影响以及越来越强的相对论效应:铜-银-金越来越像卤素锌-镉-汞越来越像稀有气体”我有一点反感这种类比,其实就是想说根据计算和实验结果,这两族元素的d电子影响元素性质,而且ns和(n-1)d之间差距越来越小。看光功能材料的时候刚好又看到这一段,其实不讨论相对论的“d电子影响说”还是挺自洽,即d电子对IB族金属的性质有明显的影响,强烈的金属键形成骨架使得铜银金具有高熔点、良好的延展性和导电性。现在的争议就是铜有没有。

回到主题,铜里百分之几的相对论效应贡献就真的不值得被讨论吗?化学上可能还没到能讨论的地步,但还是有的。[8]












暂无评论内容