“变化观念与平衡思想”是化学学科核心素养之一。化学的“变化观念”是指人们从动态的角度对化学物质变化本质的总体认识,包括守恒观、过程观与平衡观。
其中,守恒观具体包括原子守恒观念、元素守恒观念、质量守恒观念、能量守恒观念、电荷守恒观念;过程观,指的是从宏观上来看,化学变化的过程可以理解为包含始态、过渡态和终态;平衡观认为化学反应是一个复杂的系统,通过离子或电子的竞争断裂旧键形成新键,从而形成新的物质,最终整个系统形成平衡状态。
关于多平衡体系,原子守恒思想,因为只考虑平衡体系的始态和终态,完美规避反应的过程,使得解题更为简洁,而被广泛应用。这也是很典型的化学学科思维。但化学学科的发展,不能止步于只关注“始末”,而逃避“过程”!纵然守恒思想能够快速解题,但并不能否定用“三段式”来解题,以体现“过程观”和“平衡观”。
以下面这道典型题目为例,对比守恒法与“三段式”的解题优势。
碳中和是我国的重要战略目标,以H2和CO2为原料合成CH4受到广泛关注。该过程涉及以下反应:
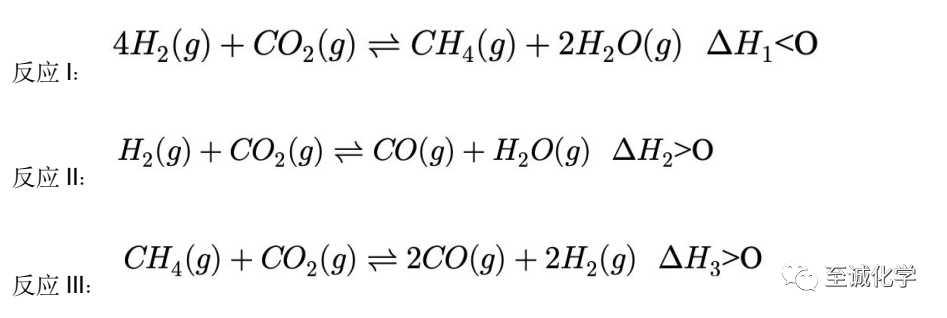
向某恒压(压强为1×105Pa)密闭容器中充入 3 mol H2(g)、1 mol CO2(g)发生上述三个反应,测得X(H2)、X(CO2)、X(CH4)和X(CO)随温度(T)的变化如图所示,其中X(i)表示平衡时某物种i的物质的量与除H2O(g)外的其他各物种总物质的量之比。

(1)图中表示X(CH4)的曲线是 (填“m”或“n”),理由是 。
解析:曲线识别的突破口在CO的变化趋势。思考:CO含量为什么在450℃开始逐渐增大?因为它是反应II和反应III的生产物,而反应II和反应III均为吸热反应,高温条件利于平衡正向进行。低温条件,利于哪个反应正向进行?反应I为放热反应,随着温度升高,平衡逆移,CH4含量减小,H2含量增大。故表示X(CH4)的曲线是 m 。
(1)450℃时,测得平衡时容器内CH4的物质的量为a mol,则H2O的物质的量为 mol,该温度下CH4的选择性为 。
已知:CH4的选择性=

,该温度下反应II的Kp= 。
◉方法一
根据元素守恒
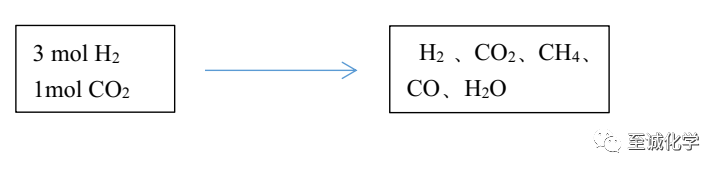
H守恒
6 mol =n(H2)×2+n(CH4)×2+n(H2O)×2
=6a+2n(H2O)
n(H2O)=3-3a mol
C守恒
1 mol = n(CO2)+n(CO)+n(CH4)= n(CO2)+n(CO)+ a ①
O守恒
2 mol= 2n(CO2)+n(CO)+n(H2O)
=2n(CO2)+n(CO)+(3-3a) ②
联立①②可得
n(CO)=3-5a mol n(CO2)= 4a-2 mol
则参加反应的CO2的物质的量为1mol –(4a-2)mol = 3-4a mol

◉方法二 三段式
先让反应I和反应II达到共同平衡
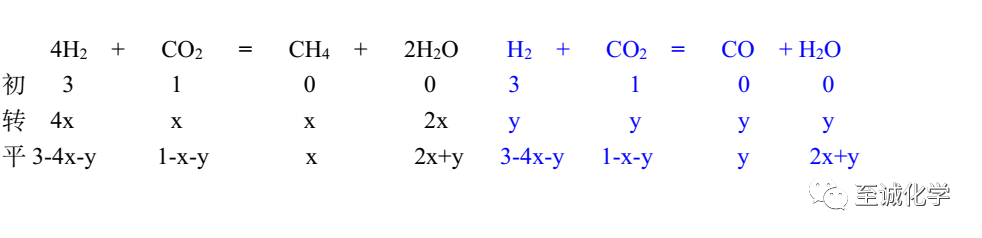
再进行反应III
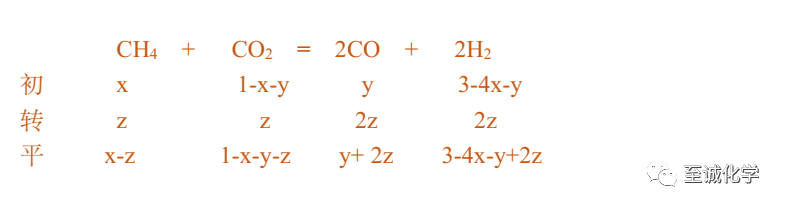
三个反应共同平衡各物种的物质的量如下表所示
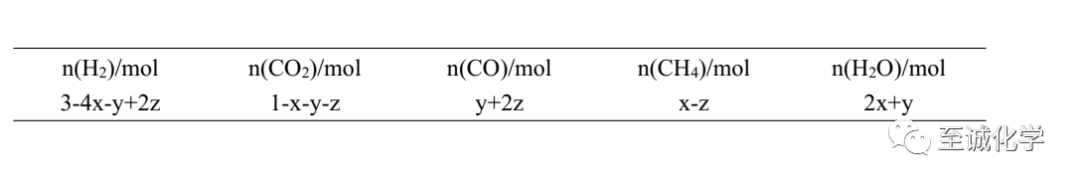
依题意
x-z=a ①
3-4x-y+2z=a ②
联立①②消去z得 2x+y=3-3a = n(H2O)③
x-z=a ①
2x+y=3-3a ③
③-①得 x+y+z =3-4a=△n(CO2)④
故n(CO2)=1-(3-4a)=4a-2 mol
可求出
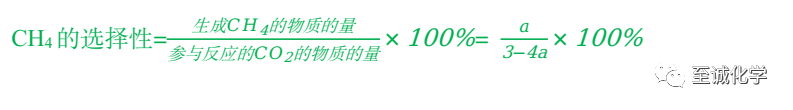
x-z=a ①
x+y+z =3-4a ④
④-①消去x得y+2z=3-5a =n(CO)
更新表格数据
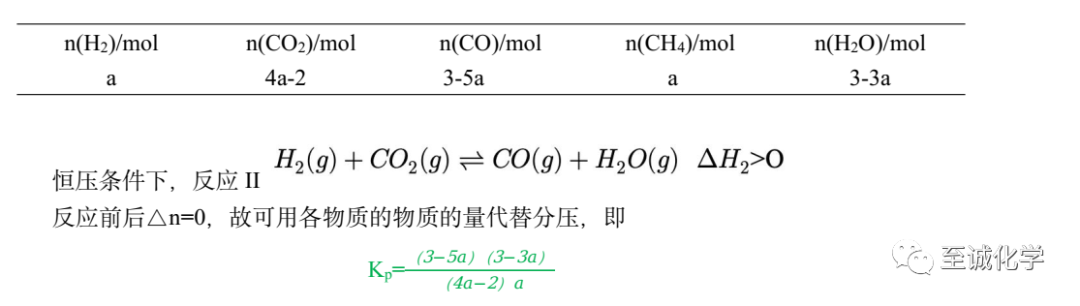
与守恒法相比,利用“三段式”法会显得“慢热”。而“三段式”的解题过程,充满了化学学科的“变化、过程与平衡”,即“三段式”具有浓烈的化学气息。守恒法很“聪明”,“三段式”很“笨拙”。
“笨拙”就一定不好吗?刘震云在北大演讲中说“(我们)这个民族最不缺的就是聪明人,最缺的就是笨人”。
大巧若拙。











暂无评论内容