
问题1:基态Fe原子价层电子如何排布?
比较3d与4s轨道的能量,空轨道时,3d轨道能量高于4s,所以当内层电子填满时,之后继续填入电子时,优先填入低能量的4s轨道,例如:
Ar原子为18号元素,电子填充情况为1s22s22p63s23p6;
K原子为19号元素,前18个电子填充情况与Ar原子相同,用[Ar]表示,第19个电子将填入低能量的4s轨道,价电子为4s1;
Ca为20号元素,与K类似,前18个电子填充情况与Ar原子相同,还有2个电子将填入低能量的4s轨道,价电子为4s2;
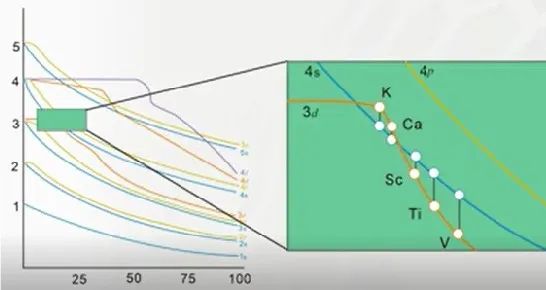
Sc为21号元素,前20个电子的填充情况与Ca相同,最后1个电子只能填入高能量的3d轨道,原子的价电子排布为3d14s2,虽然空轨道时,3d轨道能量高于4s,但轨道中填入电子后,轨道能量发生改变。由于内层的3d轨道上填充电子,内层电子(K、L、M能层)屏蔽了原子核对4s轨道上电子的吸引力,导致最外层的4s轨道能量升高,出现了4s轨道能量高于3d轨道如图-1所示;
第一种理解:Fe为26号元素,电子排布情况与Sc类似,前18个电子的填充情况为[Ar],在此基础上继续填入8个电子,其中2个电子填入低能量的4s空轨道,最后6个电子填入高能量的3d轨道,价层电子排布为3d64s2为,由于内层的3d轨道上填充6个电子,导致最外层的4s轨道能量升高,出现了4s轨道能量高于3d轨道。
第二种理解:比较电子填入原子轨道后原子的能量高低,原子的电子排布为[Ar]3d64s2或[Ar]3d8,占据高能级的4s轨道,减少了占据3d轨道所导致的电子间的排斥力。若电子排布为[Ar]3d8,d能级的5条简并轨道距离过近,8个电子都“挤占”3d能级,电子间排斥力过大,反而使Fe原子体系的能量升高;而[Ar]3d64s2的排布中,其中2个电子填入4s球形轨道,避免了8个电子同时挤占3d轨道,由于降低了电子间的斥力使得体系能量更低。
根据洪特规则,当简并轨道中存在自旋相同的单电子时,由于各电子在简并轨道间交换使得能量降低,所以[Ar]3d64s2与[Ar]3d8相比,前者5个3d简并轨道中含有4个自旋相同的单电子,而后者只有2个自旋相反的单电子,前者交换能更大,使得原子能量更低,所以基态Fe原子的电子排布为[Ar]3d64s2。
问题2:Fe失去电子形成Fe2+时,失去4s还是3d轨道上电子?
第一种理解:根据原子轨道能量高低判断,轨道中填充电子时,4s轨道能量高于3d轨道,优先失去能量更高的4s电子,Fe的价电子排布式为3d64s2,所以在失去电子时首先失去4s电子,因此Fe2+的价电子组态为3d6
第二种理解:根据原子失电子后形成离子的能量高低进行判断,能量更低的情况将是离子的电子排布。对比Fe2+与Cr的价电子排布,为什么Fe2+不是3d54s1?
软件计算结果表明Fe2+以3d6价电子组态存在能量更低
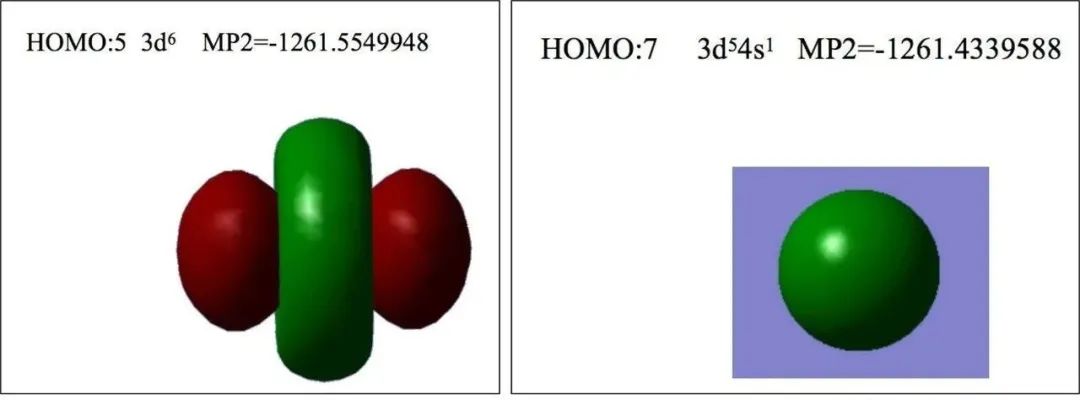
图-2 计算机模拟Fe2+的两种价层电子排布的HOMO能量
基于排斥能、轨道能量差角度解释Fe2+的价电子组态是3d6
基于电子间的排斥能和轨道间的能量差进行综合分析。3d54s1避免了3d轨道成对电子的排斥能,但是引入了4s与3d轨道间的能量差;反之,3d6避免了电子进入4s轨道的能量升高,却引入了3d轨道成对电子的排斥能。所以,何种电子组态能量更低,取决于该体系的3d同轨道里电子的排斥能与4s/3d轨道能量差之间的相对大小。
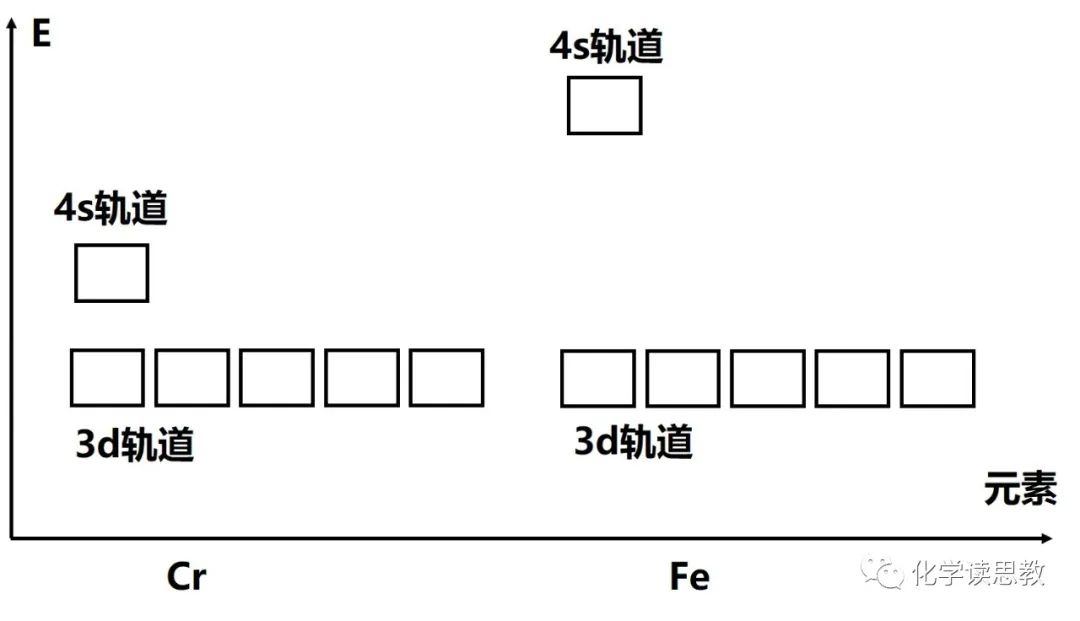
不同元素的原子4s/3d轨道能量差存在差异,如图-3所示,Cr的4s/3d轨道能量差较小,Cr的价电子以3d54s1电子组态存在,高能量的4s轨道填入1个电子避免了3d轨道电子间斥力使体系能量较低,此时3d轨道电子半排满,3d简并轨道中自旋相同的单电子最多,电子间交换能更大从而使体系能量更低。
Fe的4s/3d轨道能量差较大,对于Fe2+,由于4s轨道能量明显高于3d轨道,离子的价电子不填入4s轨道则体系的能量更低,离子更稳定,此时3d轨道填入6个电子,存在电子间的斥力使体系能量升高,但如果4s轨道填入1个电子则体系能量升高更明显,所以Fe2+以3d6电子排布存在。
说明:作者陕飞二中 石连生,转载自 Young化学,致谢!
▍ 免责声明 :本公众号部分内容转载自网络,本号特尊重原创,版权归原作者所有。本号志在为更多老师、学生及家长提供学习交流平台,转发文章不代表平台立场。如有侵权请联系我们 删除














暂无评论内容