如果您觉得对您有帮助,请帮忙点点上面分享给朋友
我们知道,通常来讲非金属性越强其最高价氧化物的水化物的酸性则越强。但是我们还应知道,很多化学规律并不准确。所以命题时应该特别小心,不应随意放飞自己。近日碰到一个比较硫酸与硒酸酸性的试题,觉得有些问题,本次给大家分析。请看下题: 
本题认为硫酸酸性大于硒酸,很多老师可能也深以为然。但是事实上这个是不对的,此处化学规律“失效”了。请看下列资料:
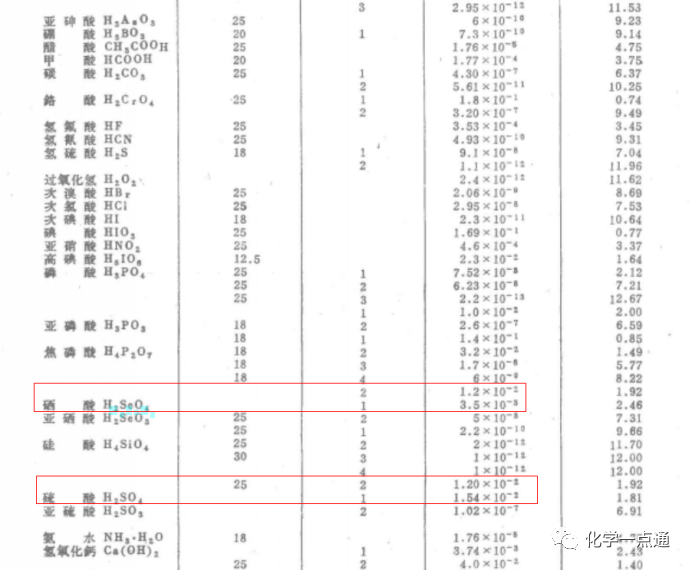 《无机化学》章閞 王夔等编写
《无机化学》章閞 王夔等编写

《环境保护知识大全》周其华等主编
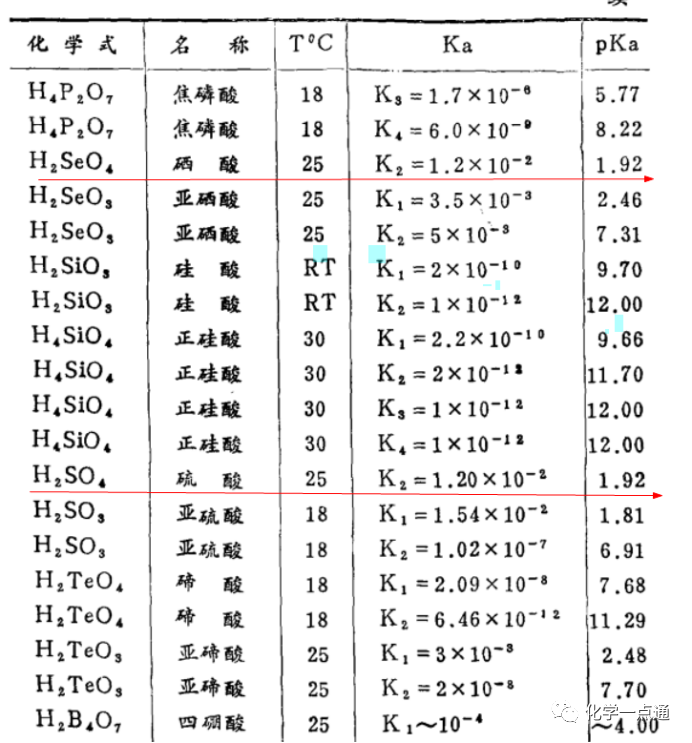
《无机化学反应方程式手册》 宋景濂编著
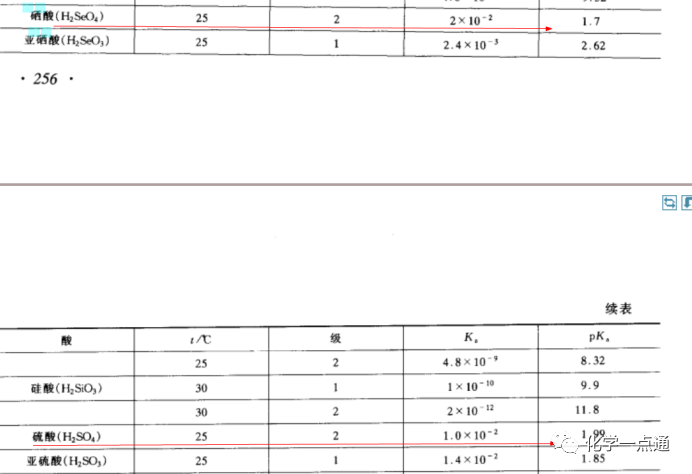
《无机化学实验 第3版》 北京师范大学无机化学教研室等编
根据很多大学资料来看,有些给出的数据是硫酸、硒酸一级完全电离,二级电离常数相同,也就是二者酸性相同。有些资料给出的数据是硒酸酸性强于硫酸,是硫酸酸性的两倍。但无论如何,不会出现硫酸酸性强于硒酸的结果。据此可知,上述试题是错误的。
如何解释硒酸酸性大于硫酸呢?我们知道实际上含氧酸酸性均由H-O键断裂产生的,而链接O原子的含氧酸中心原子(R-O-H)对羟基极性产生诱导效应导致不同含氧酸羟基极性出现差别,进而导致酸性不同。理论上讲电负性越大、氧化值越高这种诱导效应越显著。硫电负性为2.5,硒的电负性为2.4差距比较小,氧化值相同。按说应该是硫酸酸性稍强于硒酸才合理,为什么恰恰相反呢?我认为跟硫酸中的d-pπ配键有关系。请看下图:
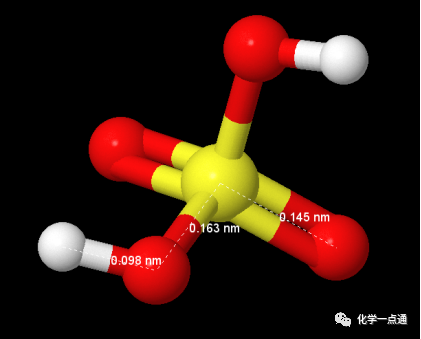
硫酸分子结构(来源于美国NIST数据库)
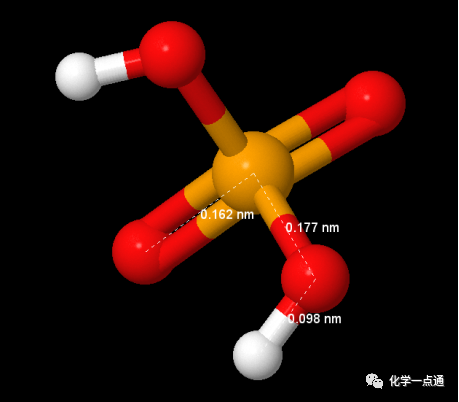
硒酸分子结构(来源于美国NIST数据库)
从分子结构看硫酸、硒酸中O-H键键长相同没有区别。但是硫酸中S=O键键长(0.145nm)明显小于Se=O键键长(0.162nm),另外S-OH键键长(0.163nm)明显小于Se-OH键键长(0.177nm)。键长S=O<Se=O是由于S与O之间存在d-pπ配键,此配键的形成导致S电子云密度增大,对羟基的诱导效应降低。Se与O之间没有d-pπ配键(或配位程度较低,没有查到相关数据,此为个人猜想)。同时键长S-OH<Se-OH所以从这个角度看,硫的诱导距离较近所以诱导效果较强。最后的结果应该是,d-pπ配键导致的诱导效应降低稍微强于S电负性稍强及R-OH键键长较短导致的诱导效应增强的效应。最终导致硫酸与硒酸酸性相同或硒酸酸性稍强的结果。
总结:含氧酸酸性比较,一般的是可以根据元素非金属性来进行分析的,大差不差基本正确。但是有些含氧酸酸性并不符合规律。硫酸与硒酸即是这一特例,由于硫酸d-pπ配键导致S原子上电子云密度增加,这样导致S对羟基的诱导效应总效果略弱于硒酸,因此致使硒酸略强于硫酸。由此带给我们的启示是,命题时对于一些不太常见的物质在运用化学规律时,最好查证一下,不要抓过来就套规律,否则可能会导致出现科学性错误。化学就是这样一个学科,规律性有但是往往每条规律下面都有一些特殊的不符合规律的东西,这也正好反映了物质的复杂性。
欢迎加微信好友进群一起交流研讨。微信号:11344195










暂无评论内容