1. 什么是轨道提到轨道我的第一反应是这个↓↓↓↓↓↓↓ 然后是这个↓↓↓↓↓↓↓
然后是这个↓↓↓↓↓↓↓

其实它是这个↓↓↓↓↓↓↓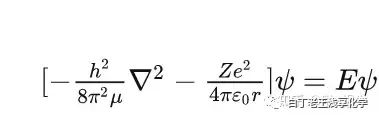 好吧,我人麻了。你没看错,是薛定谔方程,是可爱的量子力学,原子轨道是描述原子中电子运动的数学模型。对于原子轨道,检索到的定义是这样的:原子轨道可以用来计算在原子核外的特定空间中,找到原子中电子的几率,并指出电子在三维空间中的可能位置。原子轨道是单电子薛定谔方程的合理解ψ(x,y,z) /psaɪ/。若用球坐标来描述这组解,即ψ(r,θ,φ)=R(r)·Y(θ,φ),这里R(r)是与径向分布有关的函数,称为径向分布函数,用图形描述就是原子轨道的径向分布函数;Y(θ,φ)是与角度分布有关的函数,用图形描述就是角度分布函数。以及Balabala…………此处省略一万字我看到这就有些晕了,是的,很长,我没写全,因为我真的不会解薛定谔方程,我没有掌握高贵的高等数学和量子力学,我酸了,但是这些并不妨碍我学习有机化学。没错,大学阶段有机的学习可以不考虑薛定谔方程,不会解没关系(甚至考研了、毕业工作了也不用哦),真棒!对于轨道,只需要知道它是电子云,电子有波粒二象性,波函数(ψ)代表概率密度,在有机化学中就足以应付各种机理的分析讨论。当然,我可以再简化一下,必经懒人改变世界嘛,完全忘记波函数,给轨道定义一个我心目中的形象,然后赋予它两个基本要素,几何关系和轨道能级,这样就足以满足有机合成的学习需求工作需求。2. 轨道的两个要素:几何关系和轨道能级2.1几何关系原子中的电子在运动时,会存在于不同的能级中,这些能级对应着不同的原子轨道。根据量子力学的描述,这些轨道可以进一步分为s轨道、p轨道和d轨道等类型。这些轨道的名称来源于它们在波函数中的形状和对称性。s轨道是最简单的原子轨道,它的形状可以想象成一个以原子核为中心的球体。s轨道在所有方向上的扩展都是相同的,因此它的形状是球对称的。s轨道的电子云密度在原子核周围达到最大值,然后随着距离的增加而逐渐减小。p轨道的形状可以想象成两个哑铃,它们以原子核为中心对称排列。哑铃的末端是指数最大的地方,而在哑铃的中间,电子云密度较小。p轨道有三个方向,分别对应于x、y和z轴。这三个方向的轨道分别称为px、py和pz轨道。
好吧,我人麻了。你没看错,是薛定谔方程,是可爱的量子力学,原子轨道是描述原子中电子运动的数学模型。对于原子轨道,检索到的定义是这样的:原子轨道可以用来计算在原子核外的特定空间中,找到原子中电子的几率,并指出电子在三维空间中的可能位置。原子轨道是单电子薛定谔方程的合理解ψ(x,y,z) /psaɪ/。若用球坐标来描述这组解,即ψ(r,θ,φ)=R(r)·Y(θ,φ),这里R(r)是与径向分布有关的函数,称为径向分布函数,用图形描述就是原子轨道的径向分布函数;Y(θ,φ)是与角度分布有关的函数,用图形描述就是角度分布函数。以及Balabala…………此处省略一万字我看到这就有些晕了,是的,很长,我没写全,因为我真的不会解薛定谔方程,我没有掌握高贵的高等数学和量子力学,我酸了,但是这些并不妨碍我学习有机化学。没错,大学阶段有机的学习可以不考虑薛定谔方程,不会解没关系(甚至考研了、毕业工作了也不用哦),真棒!对于轨道,只需要知道它是电子云,电子有波粒二象性,波函数(ψ)代表概率密度,在有机化学中就足以应付各种机理的分析讨论。当然,我可以再简化一下,必经懒人改变世界嘛,完全忘记波函数,给轨道定义一个我心目中的形象,然后赋予它两个基本要素,几何关系和轨道能级,这样就足以满足有机合成的学习需求工作需求。2. 轨道的两个要素:几何关系和轨道能级2.1几何关系原子中的电子在运动时,会存在于不同的能级中,这些能级对应着不同的原子轨道。根据量子力学的描述,这些轨道可以进一步分为s轨道、p轨道和d轨道等类型。这些轨道的名称来源于它们在波函数中的形状和对称性。s轨道是最简单的原子轨道,它的形状可以想象成一个以原子核为中心的球体。s轨道在所有方向上的扩展都是相同的,因此它的形状是球对称的。s轨道的电子云密度在原子核周围达到最大值,然后随着距离的增加而逐渐减小。p轨道的形状可以想象成两个哑铃,它们以原子核为中心对称排列。哑铃的末端是指数最大的地方,而在哑铃的中间,电子云密度较小。p轨道有三个方向,分别对应于x、y和z轴。这三个方向的轨道分别称为px、py和pz轨道。
d轨道的形状比较复杂,它有五个方向,分别对应于x、y、z轴以及两个横向轴。这五个方向的轨道分别称为dx、dy、dz、dxz和dyz轨道。d轨道的电子云密度在原子核周围达到最大值,然后随着距离的增加而逐渐减小。除了上述三种轨道外,还有f轨道等更复杂的轨道。f轨道有七个方向,对应于三维空间中的所有方向。这些轨道在原子中的存在主要是为了满足原子中电子的排布规律和化学键的结构。不同类型的原子轨道在几何形状和对称性上都有所不同。这些不同形状和对称性的轨道使得原子在形成化学键时具有特定的方向性和立体选择性。例如,s轨道是球对称的,它可以与另一个s轨道或p轨道进行重叠,形成共价键或离子键。p轨道的方向性使得它们之间可以形成具有特定方向性的共价键。d轨道和f轨道则可以在形成复杂化学键时提供额外的方向性和立体选择性。s、p、d和f轨道是原子中电子运动的四种主要形式。它们的形状和对称性不同,这使得它们在形成化学键时具有特定的方向性和立体选择性。掌握这些轨道的形状和对称性对于理解原子中电子的行为以及分子的结构和化学性质非常重要。

几何关系小插曲:有趣的套娃式结构多层S轨道和多层P轨道的几何结构示意图,可以发现,随着套娃的继续,外层轨道的几何体积越来越大,但几何形状没有发生改变,因此只有能级上的差异,没有几何关系上的差异,分析反应机理时不会因为2S和3S的差别产生干扰。
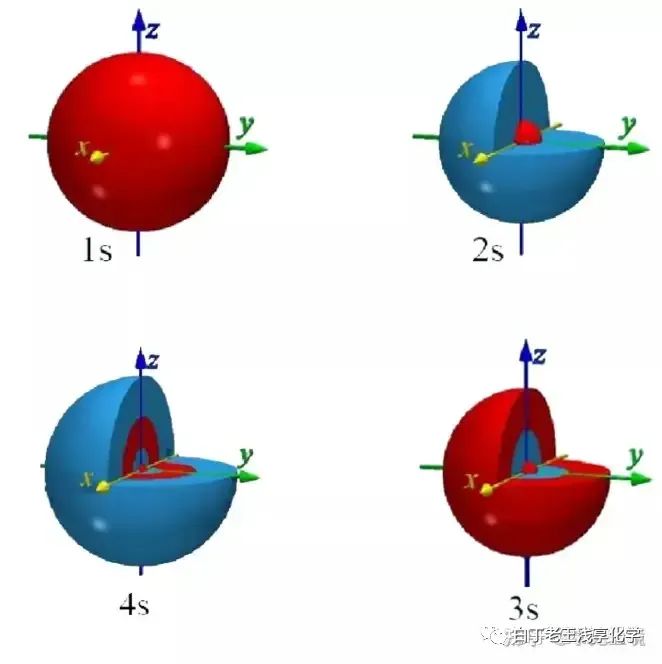
 2.2轨道能量原子中的电子在运动时,存在于不同的能级中,这些能级对应着不同的原子轨道。根据量子力学的描述,这些轨道可以进一步分为s轨道、p轨道和d轨道等类型。这些轨道的名称来源于它们在波函数中的形状和对称性。不同能级中电子的能量是不同的,一般来说,能级越高,电子的能量越大。在原子中,各轨道的能量高低顺序为:
2.2轨道能量原子中的电子在运动时,存在于不同的能级中,这些能级对应着不同的原子轨道。根据量子力学的描述,这些轨道可以进一步分为s轨道、p轨道和d轨道等类型。这些轨道的名称来源于它们在波函数中的形状和对称性。不同能级中电子的能量是不同的,一般来说,能级越高,电子的能量越大。在原子中,各轨道的能量高低顺序为:
1s3.原子轨道的几何关系和能级有什么用几何关系:判断杂化方式,对于方向性要求高的成键方式分析(例如共轭体系,反应中间体稳定性等)能级:判断反应性,分子轨道基础,机理推导依据










暂无评论内容